双自由基共轭聚合物实现生物体内高效的NIR-II光热联合免疫抗肿瘤诊疗

内容提要
目前报道的有机光热试剂的光热转换效率(PCE)仍然相对较低,特别是在近红外二区 (NIR-II,1000-1700 nm) 窗口具有良好光热性能的材料仍然很少,严重阻碍了光热治疗在抗肿瘤临床应用中的进一步发展。本文通过调节共轭分子骨架侧链,开发了一种具有超高PCE(87.7%)且稳定的共轭双自由基聚合物纳米颗粒。此外,通过将该纳米药物的NIR-II光热效应与PD-1联合使用,可以有效地阻止乳腺癌的肺部转移。这项研究探索了在NIR-II窗口中用于癌症转移治疗诊断的优良PTMs,为开发具有自由基特征的NIR-II光热材料提供了新的前景。
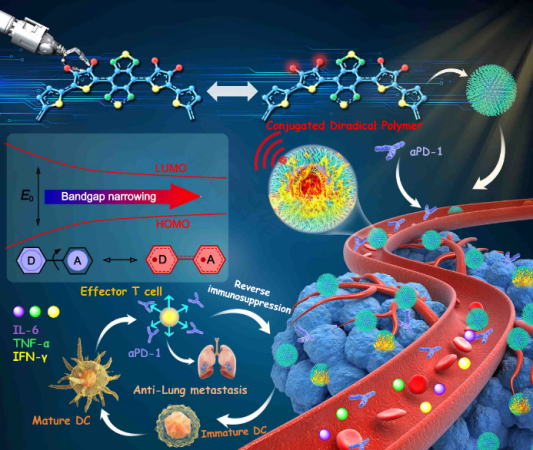
前言
光热治疗(PTT)因其超越传统治疗的非侵入性和时空分辨率特性而被广泛认为是一种有前途的治疗方法。为了实现高PTT性能,研究人员已经得出了几种有效策略来设计优异的PTT材料,包括共轭延伸、分子马达、抑制辐射跃迁和调控聚集体堆积方式等。然而,目前的有机PTT试剂的光热转换效率(PCEs)仍然相当低,尤其是在NIR-II(1000-1700nm)窗口中。此外,探索用于促进PCE的新设计机制仍然非常缺乏。因此,开发具有高NIR-II性能的新型有机PTT试剂仍然是迫切需要的。
有机自由基材料自从被报道出来以后,因具备特殊的开壳电子结构,被开发用于各种应用,主要包括磁性材料、有机发光二极管(OLED)、有机场效应晶体管(OFET)和自旋探针。最近的进展表明,具有开壳双自由基特征的有机材料通常比具有闭壳的有机材料具有明显更窄的带隙,并赋予有机自由基材料在近红外应用中的巨大前景。目前的报道包括通过超分子主客体相互作用稳定增强的有机自由基来开发近红外光热材料以及集成自由基阴离子的晶体金属有机框架(MOFs)材料,用于光热治疗应用;另外通过分子设计,稳定的含自由基阳离子的共价有机框架(COFs)和有机双自由基也被探索用于有效的NIR光热应用。然而,目前报道的研究主要集中在NIR-I区域(700-1000 nm),这限制了其在深层组织的生物医学应用。此外,提高有机自由基稳定性的新策略仍然很少有报道。因此,探索在NIR-II窗口中具有良好响应的稳定有机自由基仍然具有挑战性。
在这项研究中,研究者开发了一种具有87.7%光热转换效率的共轭双自由基聚合物,用于在NIR-II窗口中对转移性肿瘤进行有效的光热免疫治疗。我们通过侧链调节设计了D-A共轭双自由基聚合物(TTB-1和TTB-2),使PTT响应从NIR-I向NIR-II红移。在将共轭双自由基聚合物组装成水溶性纳米粒子(NPs)后,TTB-2 NPs实现了87.7%的优异光热转换效率并具有良好的稳定性。体外和体内实验表明,TTB-2 NPs在近红外窗口实现了高效的肿瘤光消融和光声成像,且无任何副作用。此外,通过将TTB-2 NPs的NIR-II PTT与PD-1相结合,对乳腺癌的肺转移抑制是非常有效的。因此,这项研究为开发第一个具有有效的NIR-II激活的肿瘤转移光免疫治疗诊断的共轭双自由基聚合物提供了新的前景。
结果与讨论
通过Stille偶联合成了两种具有典型供体(D)-受体(A)构型的共轭双自由基聚合物(CDPs)。利用密度泛函理论(DFT)计算了两种CDPs的电子分布和优化构型, 证明TTB-2具有明显的共轭平面结构和分子内电荷转移的优势。TTB-1和TTB-2都具有良好的双自由基特征和稳定性 (图1d, e)。TTB-1在THF溶剂中在750 nm左右有良好的吸收峰,而TTB-2相对TTB-1有接近200 nm的红移,最高吸收峰在950 nm附近。

通过自组装方法将上述聚合物制备成纳米颗粒(图2a)。TTB-2 NPs在950 nm处吸收峰最高,而TTB-1 NPs的最大吸收峰位于715 nm处(图2b)。透射电子显微镜(TEM)和动态光散射(DLS)结果证明TTB-2 NPs具有纳米球的形态特征(图2c),并且依然保持双自由基特性(图2d)。其次,在1064 nm激光的照射下, TTB-2 NPs具有优异的光热性能,光稳定性和超高的光热转换效率,光热转换效率(PCE)高达87.7%(图2e-h)。进一步理论计算得出开壳层单重态(OS)的激发能比闭壳层单重态(CS)低8.94 kcal mol−1,意味着TTB-2的OS态具有良好的非辐射跃迁性质,与其优异的光热性能保持一致。

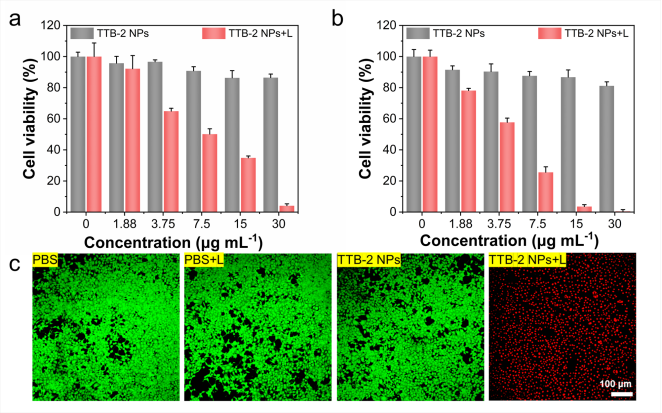
在1064 nm激光照射下,TTB-2 NPs对人宫颈癌(HeLa)细胞和小鼠乳腺癌(4T1)细胞都产生了明显的光热消融作用,在30 μg mL-1浓度时,光热8分钟可以导致近95%的细胞被完全杀死。而不照激光的情况下对细胞几乎无任何毒性,证明了其体内良好的安全性和光热抗肿瘤潜力。肿瘤细胞活/死双染实验(图3c)也同样证明了TTB-2 NPs在NIR-II区良好的抗肿瘤细胞增殖性能和生物安全性。
对4T1荷瘤小鼠静脉注射TTB-2 NPs进行PA成像,观察到TTB-2 NPs的信号在注射后9 h出现明显的峰值;24 h后几乎完全从肿瘤部位消失。肿瘤热成像结果表明在激光照射5分钟后,注射TTB-2 NPs后9小时并用1064 nm照射小鼠的肿瘤温度迅速升高至53℃,而PBS+L处理的小鼠的肿瘤温度变化不大。之后对4T1荷瘤小鼠进行体内PTT治疗。TTB-2 NPs联合激光照射治疗组小鼠的肿瘤在治疗后几乎完全消融,并且在治疗后的14天内没有复发。相比之下,单独给予TTB-2 NPs或Laser对肿瘤生长无明显影响。不同治疗后小鼠肿瘤的苏木精和伊红(H&E)染色显示TTB-2 NPs光热治疗诱导引发肿瘤部位明显的核分裂和核坏死(图4g)。此外,TUNEL和PCNA染色也表明TTB-2 NPs的光疗消融肿瘤效果。

通过联合αPD-1(抗PD-1抗体)在侵袭性肺转移瘤模型中评估TTB-2 NPs的抗肿瘤转移活性。于治疗后第18天采用流式细胞术检测不同治疗后肿瘤细胞CD8+细胞毒性T淋巴细胞(CTL)和成熟树突状细胞(DC) (CD80+CD86+)的变化,发现TTB-2 NPs 光热联合免疫治疗的CTL和成熟DC细胞明显高于其他组,证明TTB-2 NPs 光热联合免疫治疗可促进DC成熟,增强全身抗肿瘤免疫应答。酶联免疫吸附试验(ELISA)检测血清中细胞因子和促炎介质的水平证明TTB-2 NPs PTT联合αPD-1免疫治疗后小鼠血清IL-6、TNF-α、IFN-γ水平有不同比例的升高。各种治疗后进一步分析乳腺癌的肺部转移。除光热联合免疫治疗组外,其他各组小鼠肺中均出现明显的白色结节,而TTB-2 NPs + PTT + αPD-1联合治疗后小鼠肺部转移瘤明显受到抑制。这些结果表明TTB-2 NPs 光热联合免疫疗法可有效激活免疫应答,用于抗转移性乳腺癌肿瘤的治疗。

结论
本研究通过设计共轭双自由基聚合物的侧链位置,双自由基TTB-2的吸收能够扩展到NIR-II区域。基于87.7%的超高NIR-II光热转换效率,进一步证明了TTB-2纳米粒子在体外和体内通过NIR-II光照射可以实现良好的肿瘤抑制和光声(PA)成像性能。此外,与PD-1治疗相结合,TTB-2纳米颗粒实现了抑制体内乳腺癌肺转移的有效光免疫效应。因此,这种共轭双自由基聚合物丰富了近红外-红外窗口的PTT试剂,并为双自由基材料的开发提供有益的见解。
参考文献
Gao, Y., Liu, Y., Li, X. et al. A Stable Open-Shell Conjugated Diradical Polymer with Ultra-High Photothermal Conversion Efficiency for NIR-II Photo-Immunotherapy of Metastatic Tumor. Nano-Micro Lett. 16, 21 (2024). https://doi.org/10.1007/s40820-023-01219-x