
摘要
炎症性肠病(IBD)每年影响全球数百万人。肠道活性氧(ROS)在IBD的生理病理中起着至关重要的作用。纳米酶在治疗IBD方面具有很大的前景,因为它们在ros相关炎症过程中具有调节氧化还原稳态的特殊能力。然而,用于IBD治疗的口服耐酸抗氧化纳米酶的快速发展具有挑战性。本研究建立了九层高通量筛选策略,以满足IBD治疗的多方面需求,包括内在稳定性、放射性、溶解度、肠道微生物组毒性、仿生元素、中间前沿分子轨道、反应能垒、负电荷和耐酸性。从146 323个候选材料中选择Ni3S4作为最佳匹配材料,它具有超氧化物歧化酶-过氧化氢酶双酶样活性,比天然酶的活性高3.13倍和1.80倍。小鼠模型表明,Ni3S4在胃肠道中稳定无毒性,并特异性靶向病变结肠减轻氧化应激。RNA和16S rRNA测序分析表明,Ni3S4有效抑制促炎因子的细胞通路,恢复肠道微生物群。本研究开发了一种用于IBD治疗的高效口服级联纳米酶,并通过数据驱动的方法为纳米药物的合理设计提供了下一代范例。
背景简介
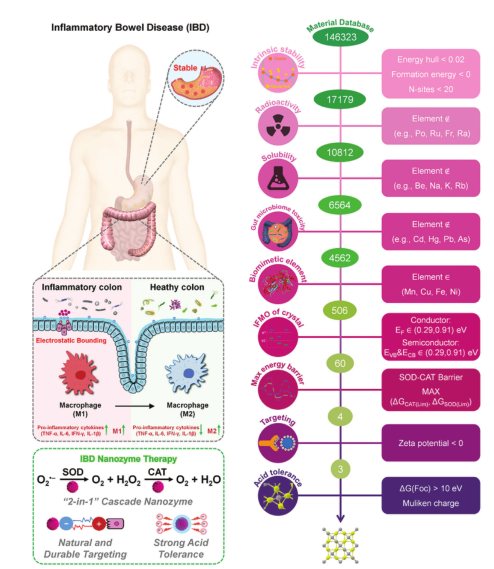
炎症性肠病(IBD)是一种无法治愈的、复发性的胃肠道慢性炎症,主要发生在年轻人身上。目前的临床治疗方法,如英夫利昔单抗和阿达木单抗,基于抗炎小分子药物、免疫抑制剂和生物制剂,治疗效果有限,并导致严重的并发症、耐药性和长期免疫相关不良事件。IBD正变得越来越普遍,每年报告的病例超过1000万例,对全球卫生保健系统构成重大挑战。纳米催化医学的进展为调节活性氧(ROS)相关炎症的氧化还原稳态提供了创新的方法。其中,抗氧化纳米酶是最具吸引力和有效的IBD治疗选择之一,它可以缓解肠道氧化应激,抑制患者肠道微生物群的炎症损伤。尽管超氧化物歧化酶(SOD)样纳米酶不能完全清除活性氧,如•OH和H2O2,但过氧化氢酶(CAT)样纳米酶的组合产生了级联纳米酶系统(SOD-CAT),具有增强的抗炎作用。此外,由于IBD的特异性病变和炎症性结肠组织的特点,口服给药需要对带正电的炎症粘膜具有高耐酸性和靶向特异性的纳米药物。虽然已经报道了几种具有上述特征的纳米酶用于IBD纳米酶治疗,但大多数是采用经验或试错方法设计的,这需要较长的开发时间和较高的成本。此外,多特征纳米酶通常表现出不足的活性和相互约束的多酶样活性。因此,合理设计用于IBD治疗的纳米酶是非常必要的。随着计算化学的进步,基于量子力学/热力学方法的分子模拟为在原子尺度上解决材料的结构-活性关系提供了另一种方法。这些模拟能够从催化机制中得出与材料性能相关的标准阈值,并利用材料数据库和高通量筛选技术来开发具有目标性能的材料。这种类型的材料设计已被用于开发纳米酶。Wang等人设计了两个原理(能级和吸附能原理),利用密度泛函理论(DFT)计算来预测金属有机框架的类钠活性。Gao等人报道了基于吸附能的描述符和材料表面CAT类活性的标准,允许使用DFT计算对材料的H2O2靶向催化活性进行全面预测。然而,关于多酶样活性筛选标准的研究尚未报道,纳米酶的不同特征与各种IBD治疗需求在高通量筛选中的整合是完全未知的。在本研究中,建立了一个强大的高通量计算策略来搜索用于IBD治疗的纳米酶(方案1),该策略通过数据挖掘、筛选标准、DFT计算和分子动力学(MD)模拟,将多方面的治疗需求转化为数字化的材料特征,并从材料项目(MP)数据库中筛选了>146 323种无机材料的候选材料。高通量筛选框架包括9个层次:固有稳定性、放射性、溶解度、肠道微生物组毒性、仿生元素、中间前沿分子轨道(iFMO)、反应能垒、负电荷和耐酸性。60种具有SOD-CAT双酶样活性的材料被鉴定出来,与IBD治疗最匹配的纳米酶是Ni3S4。为了验证预测的准确性,合成了60种材料中预测SOD-CAT性能最好的4种材料(Ni3S4、Cu3Se2、MnTiO3和Cu2SnS3),并进行了理化和生物试验。Ni3S4在体外和体内均表现出优越的疗效,最能满足IBD的治疗需求。采用RNA测序(RNA-seq)和16S核糖体RNA测序(16S rRNA-seq)分析了纳米酶治疗IBD的分子机制。
结果与讨论
根据IBD的多种治疗需求制定了一个九层高通量筛选框架。第一层是利用MP数据库中导出的地层能量(ΔE hull)来识别在零K和零压力下具有热力学相稳定性的材料,并通过原子序数极限来考虑计算表面的稳定性和复杂性。值得注意的是,ΔE壳被定义为材料在相同化学成分下分解成一组最稳定的材料的能量。选择ΔE壳<20 meV原子−1的材料作为可合成的候选材料,而n - s <20且不超过三个组成元素的材料能够在保持计算精度的同时避免计算冗余。共有17179个物料通过热力学稳定性筛选。第二层和第三层从数据库中提取放射性元素(如Po、Rn、Fr、Ra、Ac、Th、Pa和U)和可溶性金属离子(如Be2+、Na+和K+),共筛选了6564个候选元素。第四层选择的材料不含四种重金属元素(Cd、Hg、Pb和As),这些元素会导致肠道微生物群严重失调,并与IBD的发病密切相关,4562种材料符合这一标准。第五层筛选涉及对天然SOD和CAT在Mn、Fe、Ni和Cu元素范围内的催化活性中心进行仿生设计。这一层寻找含有上述一种或两种金属元素的材料,但总共不超过三种元素,并选择了1608个候选元素。第六层筛选是纳米酶在能量水平上的分类标准。基于SOD和CAT 样纳米酶的催化机制,将材料的iFMO设定为标准。SOD和CAT样纳米酶均发生歧化。歧化半反应的氧化还原电位在电子转移中起关键作用。以往的研究表明,iFMO位于歧化半反应电位之间的材料具有相应的纳米酶活性。由于SOD的氧化还原电位范围存在重叠(-0.18至 -0.91V)和CAT(0.29至-0.91V),具有iFMO的材料位于重叠电位(0.29-0.91V)范围内。被认为具有双酶样活性。共筛选了60份材料。在第七层筛选中,考虑不同的反应底物、反应途径和活性中心,计算60种材料的全SOD和CAT样反应途径的能垒,确定其CAT和SOD样活性。以0.5 eV为最大反应能(ΔGlim1)为阈值,筛选了四种最佳材料(Ni3S4、Cu3Se2、MnTiO3和Cu2SnS3)。第八层筛分采用负zeta电位材料。由于带正电荷的蛋白质在发炎的肠道中富集,表面带负电荷的纳米酶靶向发炎部位以增强其治疗效果。采用三种材料进行筛选第九层筛选评估口服给药的酸耐受性。非金属的溶解能是耐酸性能的主要指标。因此,Ni3S4被选为IBD纳米酶治疗的最佳匹配材料。天然SOD或CAT通过 机制催化歧化,其中O2•-或H2O2交替作用,还原被氧化的金属离子并氧化被还原的金属中心。这种特殊的电子传递方式为SOD或CAT金属中心的氧化还原电位设定了标准(图S1,支持信息)。要使SOD或CAT反应在热力学上有利进行,SOD的必须在- 0.18V (O2•−/H2O2)和0.91V(O2•−/O2)之间,CAT的必须在0.29V (O2•−/H2O2)和1.36V(H2O2/H2O)。之间反应中负责电子转移的材料的电子能级与天然酶不同,被定义为前沿分子轨道(FMO),其中涉及半导体的导带最小值(CBM)和价带最大值(VBM)以及导体的费米能级(EF),并且已被证明能够筛选CAT或SOD样纳米酶。因此,当材料的FMO介于0.29和0.91V之间时,假设其具有热力学有利的SOD-CAT双酶样活性,其FMO定义为iFMO。图1A描述了材料在SOD-CAT级联反应中催化的四种机制。I型表示CBM或EF为iFMO,其中反应由最高占据分子轨道(HOMO)介导,遵循HOMO介导机制。II型代表VBM或EFas iFMO,其中反应由最低未占据分子轨道(LUMO)介导,遵循LUMO介导的机制。III型表明材料中既有未占用的iFMO (CBM或EF),也有占用的iFMO (VBM或EF),并且催化反应遵循整体中性中间体的共介导机制。IV型缺乏iFMO,禁止SOD-CAT级联反应。根据iFMO的类型,将所有通过热力学稳定性筛选的506种材料分为半导体和导体组。使用MP数据库收集所有材料的iFMO数据,如支持信息(支持文件2)所示。从169种半导体中筛选出26种材料,从337种导体中筛选出34种材料,均表现出双酶样活性;55份材料未见报道(图1B,C)。通过数据可视化研究材料特性与SOD-CAT双酶样活性之间的关系。根据是否存在类双酶活性和15个重要特征变量(图1D)对材料进行分类:原子序数、材料类型、金属类型、原生金属价、次生金属价、非金属价、多价金属的存在、体积、密度、原子能、原子形成能、带隙和iFMO (CBM、VBM或EF)。含有多价态Cu、Mn和Ni的材料更有可能具有SOD-CAT双酶样活性,如MnPS3、CuPS3、Cu4SnP10和ln2Ni3S2。非金属价态的范围影响类双酶活性;非金属价态的范围越大,就越容易发生类双酶活性。当C和Si以阴离子形式存在时,例如Sc(FeSi)2、SiNi、Mn5C2和FeB,很难获得显著的SOD-CAT双酶样活性。

B、C) 506种材料的能级标准筛选。D)使用R软件中的“tabplot”包绘制iFMO对应的整个数据集的数据分布。经过能级标准筛选,鉴定出60个具有SODCAT双酶样活性的化合物。为了量化筛选材料的纳米酶活性,并排除与底物具有强化学相互作用导致双酶类活性丧失的材料,我们计算了60种材料的活性晶面的SOD和cat类反应全途径的热力学屏障(图S2,表S1,S2,支持信息)。在O2•−和H2O2歧化的关键中间态和过渡态结构中,用不同的轨道介导机制作为分界线。这种Homo介导的机制导致电子损失。带正电的物质(M+)是这个反应的中间物。在类SOD反应(图2A)中,第一个质子化的O2•−(HO2•)从H2O吸附物中夺取H原子形成H2O2,并将物质(M)氧化生成中间产物M+─OH(1)。第二个HO2•将其H原子交给M+─OH生成H2O和O2,并将M+−OH还原为初始状态M(2)。Homo介导的CAT样反应的中间体也带M+正电荷(图2B)。第一个H2O2与M的活性金属中心结合,导致O─O键断裂,随后分子内H原子转移生成中间产物M+─O,释放H2O(式(3))。第二个H2O2与M+─O反应生成O2, M+─O还原为初始状态。这种Lumo介导的机制允许材料获得电子。带负电的M−是这个反应的中间产物。在类SOD反应(图2C)中,M氧化第一个HO2•生成O2,而M被还原为还原态M−─H(5)。第二个HO2•从M−─H中取走H原子,而M被氧化为初始态M(6)。M−是Lumo介导的CAT样反应的中间体(图2D)。第一个H2O2与M的活性金属中心结合,发生分子内H原子转移,释放O2,生成中间产物M−─2H。然后,第二个H2O2与M−2H反应生成H2O , M−2H被氧化回初始状态M(8)。基于以上两种催化机制(HOMO-和LUMO-介导)衍生出的四种反应途径,计算了31种LUMO -介导材料和29种HOMO-介导材料的综合SOD-和CAT-样反应途径的反应能。极限势(ΔGlim1)被定义为SOD-和CAT -样反应的最高热力学势垒。60种材料中,SODCAT反应中Cu2SnS3 (HOMO介导)、Ni3S4 (LUMO介导)、MnTiO3 (LUMO介导)和Cu3Se2 (LUMO介导)的ΔGlim1均<0.5 eV(图2E;图S3,S4,支持信息),表明这四种材料在热力学和动力学上都有利于级联反应。根据上述反应能计算结果,确定了HOMO-和LUMO -介导的SOD-和CAT -样反应的反应规律。对于homo介导的反应,类SOD反应的速率决定步骤一般发生在HO2•与H原子反应生成H2O2的步骤,而类CAT反应的速率决定步骤是第一个H2O2的O─O键的断裂。LUMO介导的类SOD反应的速率决定步骤是第一个O-OH的O─H键的断裂,而类CAT反应的速率限制步骤是第一个H2O2的O─H键和O键的断裂。为了确定治疗IBD的最佳纳米酶,在筛选过程中考虑了治疗需求,包括负zeta电位和耐酸性。将DFT计算和MD模拟相结合,计算了四种材料的zeta电位。图2F显示了经典双电层(EDL)中界面电位与表面距离的函数示意图。表面电位(휓)在表面官能团的平面上产生,扩散层在距离表面Xd处出现。zeta电位()在扩散层(蓝色虚线)的头端得到,它限制了界面处的停滞层。表面电位计算表明,Ni3S4、Cu3Se2和Cu2Sn3具有负的zeta电位,可以特异性结合炎症(图2G;图S5,S6,支持信息)。利用离散傅里叶变换计算了四种材料的耐酸能、金属溶解能和非金属空位形成能。材料的耐酸性可以通过其表面的溶解速率来确定,这涉及到金属的溶解和由于H2O的去质子化而形成的晶格阴离子空位(图2H;图S7,支持信息)。由于它们出现的先后顺序与材料表面性质有关,因此分别计算了两种途径的反应能(表S3, Supporting Information)。结果表明,虽然整个反应是放热的,但晶格阴离子的溶解是两种反应中热力学最不利的一步。因此,这一步的自由能变化(ΔGlim2) c an b被用来确定溶解速率。Ni3S4的ΔGlim2为10.15 eV(图2I),在Ni3S4、Cu3Se2、Cu2SnS3和MnTiO3中耐酸性最强。此外,研究了表面的氧化态以了解其耐酸性。根据Mulliken电荷分析,Ni3S4中从Ni转移到S的电子数量比Cu3Se2和Cu2SnS3中要多(图S8,支持信息),验证了最强的Ni─S 键 。投影态密度计算表明,Ni3S4晶格阴离子的2p轨道位于费米能级以下(图S9, Supporting Information),表明Ni3S4具有优异的耐酸性。总的来说,Ni3S4是口服IBD治疗的最佳纳米酶。

为了验证九层高通量筛选的准确性,我们合成了四种具有优异SOD-CAT性能的材料:Ni3S4、C u3Se2、MnTiO3和Cu2Sn3,它们具有纳米花、纳米颗粒、纳米圆盘和覆树莓样的形貌,如图3A所示。x射线衍射(XRD;图3B)和x射线光电子能谱(XPS,图3C;图S10(支持信息)用于表征这些材料的晶体结构和化学成分;表征细节在支持信息中提供。通过循环伏安法测量了四种材料的氧化还原电位,曲线与MP数据库中的模拟数据一致(图S11, Supporting Information),表明这些材料符合上文讨论的SOD-CAT类双酶标准。并对四种材料的类sod活性和自由基清除能力进行了评价。已知的生物肠道自由基包括O2•−、2,2′-偶氮(3乙基苯并噻唑-6-磺酸)阳离子自由基(ABTS•+)、2,2二苯基肼基自由基(DPPH•)和羟基自由基(•OH)。四种材料均表现出优异的自由基清除能力(图3D-G;图S12-S17(支持信息),性能趋势如下:

结果表明,Cu2SnS3具有较高的•OH清除能力,Ni3S4具有最强的综合自由基清除能力,其SOD样活性是天然SOD的3.84倍,也是目前报道的大多数非复合SOD样纳米酶的活性(图S18, Supporting Information)。通过使用溶解氧计检测H2O2分解产生的O2来验证CAT类活性。在pH为9.2、反应时间为20 min时,CAT-样活性的变化趋势为Ni3S4 > MnTiO3 > CAT > Cu3Se2 > Cu2SnS3(图3H;图S19,支持信息),Ni3S4的H2O2清除活性比天然CAT高1.83倍。除了活性氧清除能力外,耐酸性是纳米酶治疗IBD的另一个基本特征。为了证实这些材料的耐酸性是否与模拟结果相符,在37℃下,用模拟胃液(SGF, pH 1.2-1.5, 0.12-0.15 m HCl溶液)处理3小时后,测量了它们的SOD-CAT双酶样活性[21]Ni3S4的SOD-和CAT样活性下降幅度最小,分别为21.1%和13.9%。Cu3Se2和Cu2SnS3的SOD样活性分别下降了24.2%和29.5%,CAT样活性分别下降了25.4%和35.1%。MnTiO3受到SOD和CAT样活性的显著影响,分别下降了51.0%和50.8%(图3I;图S20-S22,支持信息)。然后,对SGF处理后的材料的粒径和分散性进行了评价。MnTiO3耐酸性较差,粒径和分散性发生明显变化,溶液颜色也发生变化。相比之下,Ni3S4表现出了显著的耐酸性,经过SGF处理后,其粒径和分散性几乎没有改变(图S23,S24,支持信息)。这些发现与SGF处理前后的纳米酶活性测量结果一致,证实了Ni3S4的预期耐酸性。采用电感耦合等离子体质谱(ICP-MS)检测SGF处理的Ni3S4的稳定性。SGF处理3 h后,Ni3S4仍保持其晶体结构(图S25,支持信息)。负的zeta电位是IBD治疗的另一个重要特征,它允许物质靶向炎症部位如图3K所示,正常情况下Ni3S4的zeta电位为- 18.2±2.6 mV, SGF处理后Ni3S4的zeta电位保持不变(- 17.1±1.9 mV),证实了胃酸后Ni3S4靶向炎症肠道组织的zeta电位为负(图S26, Supporting Information)。Ni3S4的总体表现与口服IBD治疗的最佳匹配(图3L),这与高通量预测一致。为了进一步证明Ni3S4在口服IBD治疗中的潜力,我们使用电子顺磁共振(EPR)来评估其清除自由基的能力。如图3M所示,经SGF处理后,其变化不大。将Ni3S4的酶样活性与天然SOD和CAT进行比较。正常情况下,Ni3S4的SOD样活性为437U mg−1,CAT活性为615U mg−1(图3N),分别比天然SOD和CAT的活性高1.80倍和3.13倍。SGF处理后,SOD和CAT样活性分别为332.9和422U mg−1,在正常情况下仍大于天然酶的活性(图3O)。

用脂多糖(LPS)处理RA W264.7巨噬细胞,刺激细胞内ROS的过量产生。如图4A所示,四种材料均能在细胞内清除活性氧。流式细胞术定量测定细胞内ROS水平。从图4B、C可以看出,四种材料对ROS的清除率依次为Ni3S4 (95.58%) > Cu2SnS3(82.16%) > Cu3Se2 (69.78%) > MnTiO3(66.54%),这与动力学测量结果一致,强调了在体外具有显著的ROS清除率,尤其是Ni3S4 (T表S4, Supporting Information)。为了研究Ni3S4的抗炎活性,我们分析了关键炎症细胞因子,如白细胞介素-1γ(IL-1γ)、γ干扰素(IFN-γ)、白细胞介素-6 (IL-6)、肿瘤坏死因子(TNF-α)和白细胞介素-10 (IL-10)的mRNA表达(表S5,支持信息)。如图4D-H所示,在RA W 264.7细胞中,Ni3S4组中与细胞炎症发生相关的IL-1γ、I F N -γ、IL-6和TNF-α的促炎因子水平低于LPS组。相反,抑制炎症细胞因子产生的IL-10水平在LPS处理组中显著升高,证实Ni3S4可以减轻体外炎症反应。此外,由于ROS诱导的细胞凋亡是主要的继发性损伤因素,我们在体外研究Ni3S4是否可以减少ROS诱导的细胞凋亡。流式细胞术数据显示(图4I,J), Ni3S4显著降低LPS诱导的细胞凋亡61.96%。采用肠上皮细胞(IEC) MODE-K检测Ni3S4的生物相容性。细胞暴露于不同浓度(0 ~ 100 μm)的Ni3S4中24 h。图S27(辅助信息)显示,浓度高达100 μg m L−1的Ni3S4对细胞增殖没有影响。活细胞和死细胞的免疫荧光染色证实了Ni3S4的体外生物相容性。此外,还探讨了Ni3S4与IEC MODE-K的相互作用机理。Ni3S4粘附在细胞膜上,并通过囊泡(图S29,S30,辅助信息)以时间依赖性的方式运输到细胞内部(图S31,辅助信息);wortmannin处理后,Ni3S4的细胞摄取受到显著影响(图S32,支持信息),表明巨量胞饮途径占主导地位。

通过DSS诱导的IBD小鼠模型研究Ni3S4口服治疗IBD的疗效(图5A)。用3% DSS饲喂小鼠7 d后,诱导小鼠出现肠炎。将小鼠随机分为健康组(空白对照组)、肠炎组(DSS,阴性对照组)、5-氨基水杨酸治疗组(DSS+5-ASA,阳性对照组);5-ASA是IBD的一线药物),Ni3S4治疗(DSS + Ni3S4,实验组)。阳性对照组和治疗组每天灌胃口服5-ASA或Ni3S4,通过测定结肠长度、脾脏、体重及疾病活动指数(DAI)评价Ni3S4的治疗效果。与DSS组相比,DSS + Ni3S4和DSS + 5-ASA组结肠长度更长(图5B、D),脾脏重量更轻(图5C、E),体重更高(图5F), DAI更低(图5G)。值得注意的是,DSS + Ni3S4与健康组之间的差异明显小于DSS + 5-ASA与健康组之间的差异。这些结果表明,4 mg kg - 1 Ni3S4比50 mg kg - 1 5-ASA治疗DSS诱导的小鼠结肠炎更有效,优于大多数报道的纳米酶(表S6,支持信息)。各组结肠切片苏木精和伊红(H&E)染色结果相似。结肠炎小鼠表现为严重的隐窝破坏,组织学塌陷,大量免疫细胞浸润,炎症结肠严重的结肠上皮损伤,而DSS + Ni3S4组组织学微结构基本正常,炎症细胞浸润较少(图5H)。髓过氧化物酶(Myeloperoxidase, MPO)由中性粒细胞表达,在炎症组织中催化反应性物质和次氯酸的形成,参与IBD的调控。在图5H中,DSS组结肠组织中MPO水平升高,但Ni3S4治疗后MPO的聚集量大幅下降,证实Ni3S4可以成功改善IBD症状。Ni3S4的治疗成功依赖于其靶向特定病变的能力,同时最大限度地减少对其他器官的损害。采用ICPMS评价Ni3S4的生物安全性和代谢性能。Ni3S4处理小鼠的心脏、肝脏、脾脏、肺和肾脏中均未检测到高水平的金属离子,但在结肠组织和粪便中观察到相当多的金属离子残留(图5I),这表明Ni3S4针对发炎的结肠组织,并在不被组织细胞吸收的情况下安全地排出体外。透射电子显微镜(TEM)图像显示,Ni3S4粘附在富含正电荷蛋白的结肠炎病变上(图5J),并在4天内被移除(图S33-S35,支持信息)。此外,通过溶血实验评估Ni3S4的血液毒性,在浓度为100 μg m L−1时,观察到溶血率<2%(图S36,支持信息)。我们评估了Ni3S4对主要器官和血液常规的体内毒性,口服Ni3S4后,两者均未受到影响(图S37,S38,支持信息)还研究了Ni3S4在胃肠道中的耐酸性。在粒度分布(图S39,辅助信息)和元素组成(图S40,辅助信息)方面没有观察到显著差异。为定量测定Ni3S4的滞留时间,分析口服给药后肠内Ni浓度;Ni3S4在小鼠胃液中的溶解度被检测(图S41,支持信息)。图S42(辅助信息)显示,Ni3S4在1 h内的溶出率<1%,说明Ni3S4在体内具有良好的耐酸性。

我们对小鼠结肠组织进行RNA-seq分析,以阐明Ni3S4治疗IBD的机制。对照组、DSS组、DSS+ 5-ASA组和DSS+Ni3S4组基因表达水平的差异以每百万定位片段的外显子模型千碱基片段数表示。火山图(图6A)显示,与健康组相比,DSS组有1569个上调基因和962个下调基因。相比之下,DSS+Ni3S4组有532个基因上调,480个基因下调,提示炎症的影响。Venn图分析揭示了转录组谱的显著差异,DSS + Ni3S4组在总基因、上调基因和下调基因方面表现出比DSS + 5-ASA组更高的变异性(图6B)。这些数据表明Ni3S4治疗是有效的,并且对正常肠道没有实质性影响,因为它与健康组没有差异。归一化热图(图6C)显示,Ni3S4处理后IBD小鼠肠道组织中应答ROS的基因数量大幅减少。为了阐明潜在的治疗机制,筛选的基因进行聚类和富集分析。使用基因本体(Gene Ontology, GO)数据库对差异表达的炎症基因(differential expression inflammatory genes, DEGs)进行功能聚类分析,以log2 (fold change)作为评估标准。结果表明,DSS组和DSS + Ni3S4组之间的基因表达差异与8个氧化石墨烯类别有关:炎症反应、趋化因子信号通路以及趋化因子IL1、IL-6和TNF-α产生的调节(图6D)。基因集富集分析(GSEA)显示,在DSS组中,ROS上调的基因高度富集(图6E),但在加入Ni3S4后,这些基因的表达水平降至正常水平。功能通路富集分析(使用京都基因与基因组百科全书[KEGG])显示,趋化因子、TNF훼、磷酸肌醇3-激酶(PI3K)- akt、核因子κ B (NF-kB)、Janus激酶/信号转导和转录激活因子(JAK-STAT)信号通路均与Ni3S4的治疗机制相关(图6F;图S43,S44,支持信息)。先前有研究报道NFkB信号通路参与TNF-α、IL-1、IL-6等促炎细胞因子的产生,与IBD的发病密切相关。PI3K-Akt信号通路对NF-휅B信号通路的激活起着至关重要的作用。Ni3S4处理后,所有ROS相关的细胞通路均显著下调。这些结果表明,Ni3S4通过降低ROS水平和抑制NF-kB、趋化因子和其他炎症信号通路来减轻小鼠模型中的结肠炎症。有趣的是,Ni3S4处理影响了PI3K-Akt和toll样信号通路,这表明Ni3S4可能在IBD治疗中调节肠上皮屏障修复和肠道微生物群中发挥作用。 
肠道菌群紊乱与IBD的发病和进展密切相关。[26]肠道微生物群被认为是促氧化剂的主要来源[27],ROS的过量产生可能导致肠道屏障功能障碍和潜在有害细菌(如致病性厌氧菌)的扩张[28]。为了探究Ni3S4是否影响肠道菌群的组成和丰度,我们进行了16S rRNA-seq。相对丰度条形图(图7A)描绘了不同群体,说明了不同环境中微生物的存在以及每一群体在门水平上的相对丰度。肠道菌群主要由拟芽孢杆菌、产气荚膜梭菌、脱硫弧菌和酸微生物组成。D SS + Ni3S4组微生物种类的多样性和丰度高于健康组。非度量多维尺度分析(NMDS)消除了对实际距离值的依赖,用于评估四组微生物群落的相似距离矩阵(图7B,C)。四组之间的肠道微生物组成和功能分类存在显著差异,Ni3S4处理后的样品中微生物多样性明显高于炎症组(图S45,S46,支持信息),反映了Ni3S4对结肠炎小鼠微生物组结构的显著影响。使用微生物聚类热图(图7D)分析了50个显著不同家族的相对丰度。Ni3S4处理显著提高了Ruminococcaceae和Prevotellaceae的相对丰度,这两种细菌产生短链脂肪酸(SCFA),调节肠道屏障功能。与DSS组相比,DSS + Ni3S4组胃肠道主要致病菌的相对丰度降低,如Bacteroides(0.151-0.068)和Alistipes(0.074-0.021)。然而,益生菌的种类和丰度有所增加(图7E),如Muribacusaceae(0.175-0.200)和Prevotellaceae(0.012-0.081)。采用α多样性法测定四组微生物的物种丰度和多样性。DSS + Ni3S4组的ACE、Shannon和Simpson指数显示,Ni3S4治疗增加了观察到的操作分类单位(operational taxonomic units, OTUs)的数量,表明Ni3S4对肠道菌群结构的影响与常规抗炎药相当(图7F-H)。上述转录组学数据表明,Ni3S4可以恢复肠道屏障,调节IBD病变部位的菌群平衡。

结论
在本研究中,我们建立了一个九层高通量筛选策略,结合一种计算方法来解决IBD的多方面治疗需求。筛选阶段主要基于纳米酶的固有稳定性、放射性、溶解度、肠道微生物毒性、仿生元素、iFMO、反应能垒、负电荷和耐酸性,从而合理设计纳米酶药物。该策略提出了筛选抗氧化剂SOD-CAT类双酶活性的热力学标准,将材料范围扩大到>1500种稳定且生物安全的材料,并阐明了一系列可作为IBD治疗候选药物的纳米酶。有趣的是,化学和生物学测试以及生物信息学分析证实,最佳匹配的纳米酶Ni3S4的活性分别是天然SOD和CAT活性的3.13倍和1.80倍,能够靶向炎症肠道,减轻炎症,修复受损的肠道屏障,恢复肠道微生物群,平衡肠道微环境。综上所述,本研究为基于材料大数据和疾病特征的IBD治疗多酶样纳米酶的按需设计提供了新一代数据驱动方法,从而加速了基于纳米酶的药物发现和临床转化。
文献参考
Rational Design of Orally Administered Cascade Nanozyme for Inflammatory Bowel Disease Therapy
Yixin Yu, Xianguang Zhao, Xudong Xu, Chenwen Cai, Xuemei Tang, Qingyun Zhang, Liang Zhong, Fusheng Zhou, Dongqin Yang, Zhiling Zhu First published: 23 August 2023
https://doi.org/10.1002/adma.202304967